क्वाण्टम संख्या क्या है |क्वाण्टम संख्या के प्रकार- मुख्य द्विगंशी चुम्बकीय या दिशामान चुम्बकीय क्वाण्टम संख्या महत्व | Quantum Numbers in Hindi
क्वाण्टम संख्या के प्रकार महत्व
क्वाण्टम संख्याएँ क्या होती हैं
श्रोडिंजर समीकरण
श्रोडिंजर समीकरण को हल करने पर विभिन्न
क्वाण्टम संख्याएँ (मुख्य, दिगंशी एवं चुम्बकीय) सहज ही प्राप्त होती है। श्रोडिंजर समीकरण को तीन समीकरणों में विभक्त करने पर तीन स्थिरांक n,l एवं m उत्पन्न होते हैं जो क्वाण्टम संख्याएँ है।
- वह समीकरण जो केवल r पर निर्भर करता है, मुख्य क्वाण्टम संख्या (n)
- वह समीकरण जो θ पर निर्भर करता है, द्विगंशी क्वाण्टम संख्या (l)
- वह समीकरण जो ϕ पर निर्भर करता है, चुम्बकीय क्वाण्टम संख्या (m) देता है।
- चौथी क्वाण्टम संख्या समीकरण के हल से नहीं बल्कि स्पेक्ट्रोस्कोपी मापन से व्युत्पन्न किया जाता है।
अत: H-परमाणु से प्राप्त स्पेक्ट्रम की अति सूक्ष्म रेखाओं को
जो कि उच्च विभेदन क्षमता के स्पेक्ट्रोस्कोप से प्राप्त होती है, को स्पष्ट करने के लिए चार क्वाण्टम
संख्याएँ आवश्यक होती है।
क्वांटम संख्या किसे कहते हैं ?
- किसी परमाणु में किसी इलेक्ट्रॉन को पूर्ण रूप से अभिव्यक्त करने के लिए अर्थात् उसकी स्थिति और ऊर्जा को निर्धारित करने के लिए जिन संख्याओं का प्रयोग करते हैं, उन्हें क्वाण्टम संख्याएँ कहते हैं।
क्वांटम संख्या के प्रकार बताइए
आधुनिक विचारों के अनुसार किसी
इलेक्ट्रॉन की ऊर्जा और स्थिति का पूर्ण वर्णन करने के लिए चार क्वाण्टम संख्याओं
की आवश्यकता पड़ती है। ये क्वाण्टम संख्याएँ निम्न है
1. मुख्य
क्वाण्टम संख्या (Principal
quantum number)
2. द्विगंशी
क्वाण्टम संख्या (Azimuthal
quantum number)
3. चुम्बकीय
क्वाण्टम संख्या (Magnetic
quantum number)
4. चक्रण क्वाण्टम संख्या (Spin quantum number) |
1.
मुख्य क्वाण्टम संख्या
Principal Quantum Number
इस क्वाण्टम संख्या को n से व्यक्त करते हैं। यह क्वाण्टम संख्या परमाणु में इलेक्ट्रॉन के मुख्य ऊर्जा स्तर और कोश के आकार (size) का निर्धारण करती है। n के सम्भावित मान 1, 2, 3, हैं। n का मान बढ़ने से इलेक्ट्रॉन की ऊर्जा और उसके कोश (shell) की त्रिज्या (r) बढ़ती है।
इलेक्ट्रॉन की ऊर्जा मुख्यतः n के मान पर निर्भर करती है। n का मान कभी शून्य नहीं होता। परमाणु के किसी कोश में उपस्थित इलेक्ट्रॉन की ऊर्जा निम्न सूत्रों से निकाल सकते हैं
यह सूत्र केवल उन परमाणु और आयनों के लिए
है जिनमें केवल एक इलेक्ट्रॉन जैसे H-परमाणु He+, Li2+ आदि होता है।
यहाँ Z नाभिक में
प्रोटॉनों की संख्या है।
किसी परमाणु के विभिन्न कोशों (orbits) की त्रिज्या निम्न सूत्र में निकाल सकते है
r=-0.529 n2/Z A
यह सूत्र भी केवल उन परमाणु और आयनों के
लिए है जिनमें केवल एक इलेक्ट्रॉन होता है।
मुख्य क्वाण्टम संख्या n का महत्व
Significance of Principal
Quantum Number n
(1) n के मान कोशों की संख्या दर्शाते है जिन्हें बड़े अक्षरों से व्यक्त किया जाता है।
(ii) n इलेक्ट्रॉन का मुख्य ऊर्जा स्तर एवं कोश का आकार निर्धारित करता है।
(iii) n किसी कक्षा में इलेक्ट्रॉन की ऊर्जा निर्धारित करते हैं
यहाँ
En = इलेक्ट्रॉन की ऊर्जा
m = इलेक्ट्रॉन का द्रव्यमान
e = इलेक्ट्रॉन पर आवेश
Z = तत्व का परमाणु क्रमांक
h = प्लांक नियतांक
n = मुख्य क्वाण्टम संख्या
(iv) कोश (कक्षा) में अधिकतम इलेक्ट्रॉनों की संख्या देता है।
द्विगंशी क्वाण्टम संख्या
Azimuthal Quantum Number
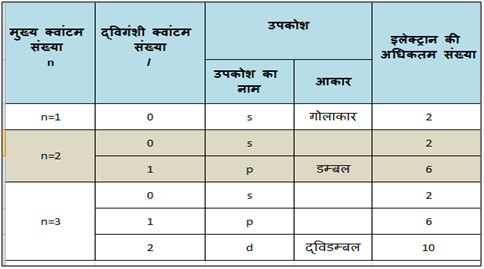
- इस क्वांटम संख्या को l से प्रकट करते हैं। यह किसी परमाणु में इलेक्ट्रॉन के उप-ऊर्जा स्तर (sub energy level) को प्रदर्शित करता है। l का मान सब-शैल के ऑर्बिटलों की आकृति (shape) को भी निर्धारित करता है। / के मान मुख्य क्वाण्टम संख्या (n) पर निर्भर करते हैं। n के किसी मान के लिए l के मान 0 से लेकर (n-1) तक कुल n होते हैं। अब तक ज्ञात तत्वों के लिए / के अधिकतम चार मान 0. 1, 2 व 3 होते हैं, जो क्रमश: उपकोशो या उप-ऊर्जा स्तरों को प्रकट करते हैं। सारणी में दर्शाए अनुसार आगे की संख्या परिकलित की जा सकती है।
मुख्य क्वाण्टम संख्या तथा दिगंशी
क्वाण्टम संख्या में सम्बन्ध
इस प्रकार हम कह सकते हैं कि पहले कोश
में एक उपकोश अर्थात् (स्फुट या sharp), दूसरे में दो s तथा p (मुख्य या principal), तीसरे में तीन s, p तथा d व (अस्फुट या diffused) तथा चौथे में चार s, p, d तथा f (मौलिक या fundamental) होते है। s, p, d तथा f इन चारों में s की ऊर्जा सबसे कम तथा f की ऊर्जा सबसे अधिक होती है।
द्विगंशी क्वाण्टम संख्या l का महत्व
Significance of
Azimuthal Quantum Number l
(i) / का मान उपकोशों की आकृति दर्शाता है।
जैसे- / =0, गोलाकार
/
= 1, डम्बल
/
= 2, द्विडम्बल
(ii) मुख्य कोश में उपकोशों की कुल संख्या निर्धारित करता है।
जब n = 1, / = 0 K कोश में एक ही उपकोश 1s होता है।
जब n = 2, / = 0,1 L कोश में दो उपकोश 2s एवं 2p होते है।
जब n = 3, / = 0, 1, 2 M-कोश में तीन उपकोश 3s, 3p एवं 3d होते है।
जब n = 4, / = 0, 1, 2, 3
N-कोश में चार उपकोश 45, 4p, 4d एवं 4f होते है।
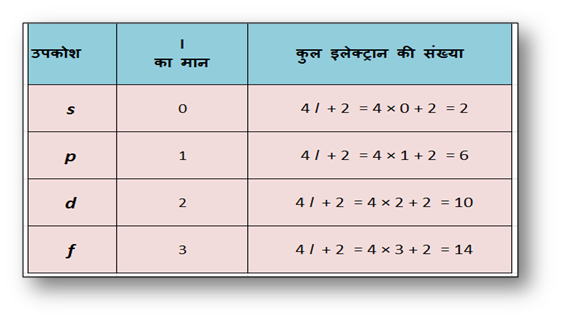
(iii) / की सहायता से किसी उपकोश में कुल इलेक्ट्रॉनों की संख्या की गणना की जा
सकती है।
चुम्बकीय या दिशामान क्वाण्टम संख्या
Magnetic or Orientation Quantum Number
- इस क्वाण्टम संख्या को m द्वारा प्रदर्शित किया जाता है। चुम्बकीय क्वाण्टम संख्या सब शैल या उपकोश के कक्षकों (orbitals) को प्रदर्शित करती है। यह ऑर्बिटल के अभिविन्यास (orientation) को भी व्यक्त करती है। के मान द्विशी क्वाण्टम संख्या पर निर्भर करते है / के किसी मान के लिए m के मान (-/ से +/ ) या (+/ से -/) तक शून्य साहित होते हैं। अर्थात / के किसी मान के लिए कुल मान (2 / + 1) के बराबर होंगे, m के कुल मान उपकोश में कक्षकों की कुल संख्या को प्रदर्शित करते है। एक कोश में कक्षकों की संख्या n2 होती है।
चुम्बकीय क्वाण्टम संख्या (m) का महत्व
Significance of Magnetic Quantum Number (m)
(i) उपकोश
में कुल ऑर्बिटलों की संख्या गणना करने में m के
विभिन्न मान मदद करते हैं।
(a) s-उपकोश
के लिए / = 0, m = 0
अतः ns उपकोश में एक ही ऑर्बिटल होता है।
(b) p-उपकोश के लिए /= 1, m = -1 ,0, + 1
m के तीन मान हैं, इसलिए
np उपकोश में तीन ऑर्बिटल Px, Py एवं Pz होते हैं।
(c) d उपकोश के लिए / = 2, m = -2, -1, 0, + 1, + 2
d उपकोश में 5
(पाँच) ऑर्बिटल dxy, dyz, dxz, dx, dx 2-y2 एवं dz2 होते हैं।
(ii) चुम्बकीय
क्षेत्र में किसी उपकोश के ऑर्बिटलों का अभिविन्यास m के विभिन्न मानों से ज्ञात करते हैं।
(a) जब / = 0, m = 0, एक मान
इसलिए
s-ऑर्बिटल में केवल एक अभिविन्यास है।
(b) जब / = 1, m= -1,0, +1.
p-ऑर्बिटल चुम्बकीय क्षेत्र तीन Px ,Py,Pz अभिविन्यास दर्शाता है।
(c) जब / = 2, तो m=-2, 1, 0, + 1, + 2 अत: d -उपकोश चुम्बकीय क्षेत्र में 5 (पाँच) विभिन्न ऑर्बिटलों वाला अभिविन्यास
दर्शाता है।
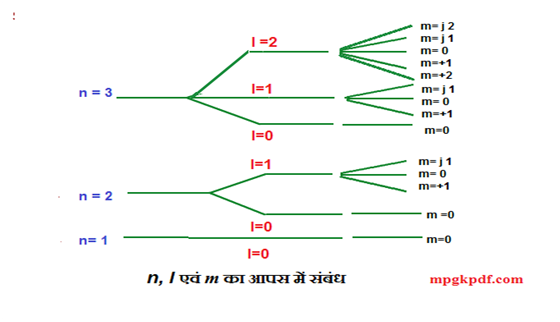
क्वाण्टम संख्याओं n, l एवं m के बीच सम्बन्ध
Relation between quantum numbers n,l and m
n, / एवं m के आपस के सम्बन्ध को निम्न आरेख
द्वारा दर्शाया जाता है।
चक्रण क्वाण्टम संख्या
Spin Quantum Number
- इसे s से प्रदर्शित करते हैं। किसी परमाणु में इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगाता है एवं अपने स्वयं के अक्ष (axis) पर भी चक्रण करता है, चक्रण क्वाण्टम संख्या से ज्ञात होता है कि किसी कक्षक में इलेक्ट्रॉन दक्षिणावर्त (clockwise) दिशा में घूम रहा है या वामावर्त (anticlockwise) दिशा में अर्थात् यह क्वाण्टम संख्या इलेक्ट्रॉन के चक्रण की दिशा को प्रदर्शित करती है। अतः m के किसी मान के लिए के s केवल 2 ही मान हो सकते हैं।
- m के किसी मान के लिए s के मान +½ या - ½ होते हैं। s के मानों को ↑ (clockwise) या ↓ (anticlock-wise) द्वारा भी प्रकट करते हैं। यह क्वाण्टम संख्या किसी परमाणु अथवा आयन के चुम्बकीय गुणों (magnetic properties) की व्याख्या करती हैं।










Thank you
ReplyDeleteThanks
ReplyDelete